
Özkütle Formülü Nedir?
Özkütle, bir maddenin birim hacmindeki kütle miktarını ifade eden fiziksel bir özelliktir. Özellikle mühendislik ve bilimsel araştırmalarda önemli bir parametre olan özkütle, malzeme seçiminden kimyasal reaksiyonlara kadar birçok alanda kritik rol oynar. Bu yazıda, özkütle formülü ve hesaplama yöntemleri ele alınmaktadır.
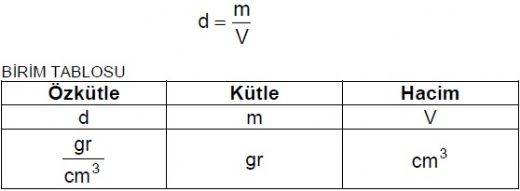
Özkütle, bir maddenin birim hacmindeki kütle miktarını ifade eden bir fiziksel özelliktir. Özkütle, özellikle fizik, kimya ve mühendislik alanlarında önemli bir parametre olarak karşımıza çıkar. Bu formül, bir maddenin yoğunluğunu ve fiziksel özelliklerini belirlemek için kullanılır. Özkütle Formülünün Matematiksel İfadesi Özkütle (ρ) formülü, aşağıdaki gibi matematiksel olarak ifade edilir: Burada;
Bu formül, kütle ve hacim arasındaki ilişkiyi gösterir ve bir maddenin özkütlesini hesaplamada kullanılır. Özkütlenin Önemi Özkütle, birçok bilimsel ve mühendislik uygulamasında kritik bir rol oynamaktadır. Özkütlenin önemi şu şekillerde öne çıkmaktadır:
Özkütle Hesaplama Örnekleri Özkütle hesaplaması, farklı maddeler için yapılabilir. Aşağıda basit bir örnek verilmiştir: Örnek: Bir metal küpün kütlesi 500 gram ve hacmi 100 cm³'tür. Özkütlesi nasıl hesaplanır? Hesaplama:
Sonuç olarak, bu metal küpün özkütlesi 5 g/cm³'tür. Sonuç Özkütle, bir maddenin fiziksel özelliklerini anlamak ve çeşitli alanlarda uygulama yapmak için kritik bir parametredir. Özkütle formülü, kütle ve hacim arasındaki ilişkiyi basit bir şekilde gösterir. Bu formül, mühendislikten kimyaya birçok bilim dalında yaygın olarak kullanılmakta ve pratik uygulamalarda önemli bir rol oynamaktadır. Özkütle hesaplama, bilimsel araştırmalar ve endüstriyel tasarımlar için vazgeçilmez bir araçtır. Ekstra Bilgiler Özkütle, bir maddenin sıcaklığına ve basınca bağlı olarak değişebilir. Örneğin, gazların özkütlesi sıcaklık artışıyla genellikle azalırken, sıvılar için bu durum daha karmaşık olabilir. Bu nedenle, özkütle hesaplamalarında, belirli koşullar altında yapılan ölçümlerin dikkate alınması önemlidir. Ayrıca, bazı maddelerin özkütleleri birbirine çok yakın olduğundan, ayrım yapmak için daha hassas ölçüm teknikleri kullanılabilir. Bu makale, özkütle formülünün temel kavramlarını, önemini ve hesaplama yöntemlerini açıklamaktadır. Daha derinlemesine bilgi için ilgili literatür incelenebilir. |















































özkütle hakkında bilgi ararken karşıma çıkan bu yazıyı okudum ve birşey kafamı karıştırdı. Sıcaklığın özkütle üzerindeki etkisi anlatılıyor, fakat suyun +4°C sıcaklıkta yoğunluğunun neden maksimum olduğunu mantıken açıklayabilir misiniz? Bu özel durumun bilimsel bir sebebi var mı?
Timurtaş,
Suyun +4°C'de yoğunluğunun neden maksimum olduğu konusu gerçekten ilginç ve özel bir durumdur. Bu durumun bilimsel bir sebebi vardır ve suyun moleküler yapısıyla ilgilidir. Su molekülleri (H2O), hidrojen bağları oluşturarak birbirine bağlanır. Bu bağlar, suyun sıcaklığına bağlı olarak farklı şekillerde hareket eder.
+4°C'de, su molekülleri arasındaki hidrojen bağları en düzenli şekilde dizilir ve su molekülleri birbirine en yakın konuma gelir. Bu durum, suyun yoğunluğunun maksimum olmasına neden olur. Daha sıcak veya daha soğuk sıcaklıklarda, moleküller arasındaki hareketlilik artar ve moleküller birbirinden uzaklaşır, bu da yoğunluğun azalmasına yol açar.
Bu özel durum, suyun doğada benzersiz davranışlarından biridir ve yaşamın devamı için önemli bir rol oynar. Örneğin, göllerin ve nehirlerin yüzeyinin donmasına rağmen alt katmanlarının sıvı kalması bu özellik sayesinde mümkün olur.
Umarım bu açıklama kafandaki karışıklığı gidermeye yardımcı olur.
Sevgiler,