Gaz Basıncı Formülü Nelerdir?
Gaz basıncı, bir gazın belirli bir alanda uyguladığı kuvvetin ölçüsüdür ve gazların davranışını anlamak için kritik bir kavramdır. Boyle, Charles, Avogadro ve Ideal Gaz Yasası gibi temel ilkeler, gazların fiziksel özelliklerini ve uygulama alanlarını keşfetmek için kullanılır.
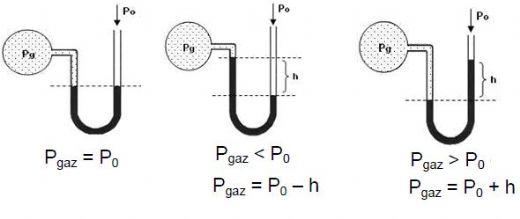
Gaz Basıncı Formülü Nedir?Gaz basıncı, bir gazın belirli bir alanda uyguladığı kuvvetin ölçüsüdür. Gazların davranışını anlamak için kullanılan temel kavramlardan biridir. Gaz basıncı, genellikle atmosfer (atm) ya da Pascal (Pa) cinsinden ifade edilir. Gazların basıncı, moleküllerin hareketine ve çarpışmalarına bağlı olarak değişir. Gaz Basıncı Formülünün Temel İlkeleri Gaz basıncı ile ilgili temel ilkeler, gazların durumunu belirleyen birkaç ana yasa ile ilişkilidir. Bu yasalar aşağıdaki gibidir:
Boyle Yasası Boyle Yasası, sabit sıcaklık altında bir gazın basıncı ile hacmi arasında ters bir ilişki olduğunu belirtir. Bu yasa, aşağıdaki formülle ifade edilir: P1 V1 = P2 V2Burada;- P1: İlk basınç- V1: İlk hacim- P2: Son basınç- V2: Son hacimBu formül, bir gazın hacmi azaltıldığında basıncının arttığını ve hacmi artırıldığında basıncının azaldığını gösterir. Charles Yasası Charles Yasası, sabit basınç altında bir gazın hacminin sıcaklık ile doğru orantılı olduğunu ifade eder. Bu yasa, aşağıdaki formülle gösterilir: V1 / T1 = V2 / T2Burada;- V1: İlk hacim- T1: İlk sıcaklık (Kelvin cinsinden)- V2: Son hacim- T2: Son sıcaklık (Kelvin cinsinden) Bu formül, bir gazın sıcaklığı arttıkça hacminin de artacağını belirtir. Avogadro Yasası Avogadro Yasası, sabit sıcaklık ve basınç altında, eşit hacimdeki gazların aynı sayıda molekül içerdiğini belirtir. Bu yasa aşağıdaki formülle ifade edilir: V1 / n1 = V2 / n2Burada;- V1: İlk hacim- n1: İlk mol sayısı- V2: Son hacim- n2: Son mol sayısıBu formül, mol sayısının artırılmasıyla hacmin de artırılabileceğini gösterir. Ideal Gaz Yasası Ideal Gaz Yasası, gazların davranışlarını açıklamak için kullanılan en kapsamlı formüldür. Bu yasa, aşağıdaki formül ile ifade edilir: PV = nRTBurada;- P: Gazın basıncı- V: Gazın hacmi- n: Gazın mol sayısı- R: Gaz sabiti (8.314 J/(mol·K))- T: Gazın sıcaklığı (Kelvin cinsinden) Ideal Gaz Yasası, gazların ideal koşullar altında nasıl davrandığını anlamak için kullanılır. Ancak, yüksek basınç ve düşük sıcaklık gibi koşullarda gazlar ideal davranış sergilemeyebilir. Gaz Basıncı ve Uygulamaları Gaz basıncı, birçok endüstriyel ve bilimsel uygulamada önemli bir rol oynar. Örneğin:
Gaz basıncının anlaşılması, mühendislik tasarımlarında ve bilimsel araştırmalarda kritik bir öneme sahiptir. Sonuç Gaz basıncı formülleri, gazların fiziksel davranışlarını anlamak ve uygulama alanlarını keşfetmek için temel bir araçtır. Boyle, Charles, Avogadro ve Ideal Gaz Yasası, gazların davranışını açıklamak için kullanılan temel kavramlardır. Bu yasaların doğru bir şekilde anlaşılması, gazların uygulama alanlarında etkili bir şekilde kullanılmasını sağlar. Ek bilgi olarak, gerçek gazların davranışlarını anlamak için Van der Waals denklemi gibi daha karmaşık modeller de bulunmaktadır. Bu denklemler, gazların etkileşimlerini ve moleküler hacimlerini dikkate alarak gerçek dünya koşullarında daha doğru sonuçlar elde edilmesine yardımcı olur. |



































Gaz sabiti formülü PV=nRT ile gazların davranışını anlamak için kritik bir öneme sahip. Bu formül, basınç, hacim, mol sayısı ve sıcaklık arasındaki ilişkiyi ortaya koyuyor. Gaz sabiti, farklı gazların ideal koşullar altında nasıl davrandığını açıklamakta temel bir araçtır.
Gaz Sabiti ve Önemi
Nevide, belirttiğin gibi gaz sabiti formülü PV=nRT, gazların davranışlarını anlamada oldukça kritik bir yere sahiptir. Bu formül, gazların fiziksel özelliklerini ve değişimlerini açıklamak için bilimsel bir temel sunar.
Formülün Bileşenleri
Formülde yer alan P (basınç), V (hacim), n (mol sayısı), R (gaz sabiti) ve T (sıcaklık) her biri gazların davranışını etkileyen önemli faktörlerdir. Bu parametreler arasındaki ilişkiyi anlamak, gazların ideal koşullar altında nasıl hareket ettiğini kavramamıza yardımcı olur.
Gerçek Hayattaki Uygulamaları
Gaz sabiti formülünün pratikte birçok uygulaması vardır. Örneğin, mühendislik, kimya ve fizik alanlarında gazların davranışlarını tahmin etmek için sıkça kullanılır. Ayrıca, gazların depolanması ve taşınmasında da bu formülün sağladığı bilgiler önemlidir.
Sonuç olarak, gaz sabiti formülü, gazların özelliklerini ve davranışlarını anlamak için temel bir araçtır ve bilimsel çalışmalarda geniş bir uygulama alanına sahiptir.
Gaz basıncı formülü 10. sınıf konularından biri olarak oldukça önemlidir. Boyle ve Charles yasaları, gazların davranışını anlamak için temel oluşturur. Bu yasaları öğrenmek, gazların basınç ve hacim ilişkisini kavramak açısından kritik bir adımdır. Gaz fiziği ile ilgili çalışmalarda bu formüllere sıkça başvuruluyor.
Gaz Basıncı Formülü ve Önemi
Neriman, gaz basıncı formülü, 10. sınıf kimya dersinde önemli bir yer tutar. Bu formül, gazların fiziksel özelliklerini anlamamızda büyük bir yardımcıdır. Boyle ve Charles yasaları, gazların basınç ve hacim arasındaki ilişkiyi açıklamakta kritik bir rol oynar. Bu yasaları öğrenmek, gazların davranışını anlamak için temel bir adım oluşturur.
Boyle ve Charles Yasaları
Boyle Yasası, sabit sıcaklıkta bir gazın hacminin basıncıyla ters orantılı olduğunu belirtirken, Charles Yasası ise sabit basınçta bir gazın hacminin sıcaklığıyla doğru orantılı olduğunu ifade eder. Bu yasaların birlikte kullanımı, gazların davranışları hakkında kapsamlı bir bilgi sağlar.
Gaz Fiziği Çalışmalarında Kullanım
Gaz fiziği ile ilgili çalışmalarda bu formüller sıklıkla başvurulan önemli araçlardır. Öğrencilerin bu konudaki bilgilerini pekiştirebilmeleri için pratik uygulamalar yapmaları ve çeşitli problemler çözmeleri faydalı olacaktır. Gazların davranışlarını anlamak, sadece teorik bilgi değil, aynı zamanda deneysel gözlemlerle de desteklenmelidir. Bu bağlamda, gazların özelliklerine dair daha derin bir anlayış geliştirmek, fizik ve kimya alanlarında ilerlemek için önemlidir.
Gaz basıncı 10.sınıf konularından biri olarak oldukça önemli. Gaz basıncı formülü, P·V = n·R·T, gazların özelliklerini anlamamıza yardımcı oluyor. Sıcaklık ve hacim değişimleri, basıncı etkilediği için bu konu hem teorik hem de pratik açıdan dikkate alınmalı. Gazların davranışlarını öğrenmek, günlük yaşamda da faydalı.
Keramet Bey,
Gaz Basıncı ve Önemi konusunda yaptığınız vurgular oldukça yerinde. Gazların davranışlarını anlamak, özellikle P·V = n·R·T formülü ile birlikte, fiziksel olayların temelini oluşturuyor. Bu formül, gazların sıcaklık, hacim ve basınç değişimlerinin birbirleriyle olan ilişkisini net bir şekilde ortaya koyuyor.
Sıcaklık ve Hacim Etkisi ise gazların davranışını anlamada kritik bir rol oynuyor. Örneğin, bir gazın hacmi arttığında, eğer sıcaklık sabit kalırsa, basıncın azalacağını görürüz. Bu tür bilgiler, hem bilimsel çalışmalarda hem de günlük yaşamda birçok alanda uygulama bulmaktadır.
Pratik Uygulamalar açısından da gaz basıncının önemi büyüktür. Örneğin, hava basıncının değişimi hava durumu tahminlerinde, araçların motor verimliliğinde ve hatta solunum sistemimizde bile gözlemlenebilir. Bu nedenle, gazların özelliklerini anlamak, sadece teorik bir bilgi olmaktan öte, yaşamımızın birçok alanında karşılaştığımız pratik bir konu haline geliyor.
Bu konudaki görüşlerinizi paylaştığınız için teşekkür ederim. Eğitiminizde başarılar dilerim!
Gaz basıncı nedir, gerçekten merak ediyorum. Gazların molekül sayısı ve sıcaklığı arttıkça basıncın nasıl değiştiğini öğrenmek ilginç. Hacim arttığında basıncın azalması da dikkat çekici. Bu konuyla ilgili daha fazla bilgi alabilir miyim?
Gaz Basıncı Nedir?
Gaz basıncı, gaz moleküllerinin bir yüzeye çarparak oluşturduğu kuvvetin, o yüzeyin alanına oranıdır. Gazlar, moleküllerinin sürekli hareket etmesi nedeniyle çevrelerine çarparak basınç oluştururlar. Bu basınç, gazın sıcaklığı, hacmi ve molekül sayısı gibi faktörlerden etkilenir.
Basınç ve Sıcaklık İlişkisi
Sıcaklık arttıkça, gaz moleküllerinin kinetik enerjisi de artar. Bu, moleküllerin daha hızlı hareket etmesine ve dolayısıyla daha sık çarpmasına neden olur. Sonuç olarak, gazın basıncı artar. Bu ilişki, Charles Yasası ve Gay-Lussac Yasası gibi gaz yasalarıyla açıklanabilir.
Molekül Sayısı ve Basınç
Gazın molekül sayısı arttıkça, moleküllerin birbirlerine çarpma sıklığı artar. Bu da basıncın yükselmesine neden olur. Örneğin, bir balonun içine daha fazla gaz eklediğinizde, içindeki basınç artar çünkü daha fazla molekül, balonun iç yüzeyine çarpar.
Hacim ve Basınç İlişkisi
Hacim arttıkça, gaz molekülleri arasındaki mesafe de artar. Bu durumda, moleküllerin birbirine çarpma sıklığı azalır ve dolayısıyla basınç düşer. Bu durum, Boyle Yasası ile açıklanır; sabit sıcaklıkta, gazın hacmi ile basıncı ters orantılıdır. Yani hacim arttıkça basınç azalır.
Dilan, gazların davranışlarını anlamak için bu temel prensipleri bilmek oldukça önemlidir. Eğer bu konuda daha fazla bilgi istersen, fizik veya kimya kitapları oldukça yararlı olabilir.
Gaz basıncı formülü ile ilgili çok bilgi verdiniz, ancak basıncın formülü nedir diye merak ediyorum. P·V = n·R·T ifadesini daha detaylı açıklayabilir misiniz? Özellikle R'nin değeri ve gazların özelliklerine etkisi hakkında bilgi almak isterim.
Gaz Basıncı Formülü
Gaz basıncı ile ilgili formül, ideal gaz yasası olarak bilinir ve P·V = n·R·T ifadesiyle temsil edilir. Burada; P basıncı, V hacmi, n mol sayısını, R gaz sabitini ve T sıcaklığı ifade eder. Bu formül, bir gazın davranışını ve çeşitli koşullar altındaki özelliklerini anlamak için temel bir araçtır.
Değerler ve Açıklamaları
- P (Basınç): Gazın birim alana uyguladığı kuvveti belirtir. Genellikle atmosfer (atm), Pascal (Pa) veya milimetre cıva (mmHg) cinsinden ifade edilir.
- V (Hacim): Gazın kapladığı alanı belirtir. Genellikle litre (L) veya metreküp (m³) cinsinden ölçülür.
- n (Mol Sayısı): Gazın kaç mol olduğunu ifade eder. Bir mol, Avogadro sayısına (yaklaşık 6.022 x 10²³) eşittir.
- R (Gaz Sabiti): İdeal gaz yasasında sabit bir değerdir ve farklı birim sistemlerine göre değişiklik gösterir. En yaygın değerlerden biri, 0.0821 L·atm/(K·mol) şeklindedir. Diğer bir değer ise 8.314 J/(K·mol) olarak ifade edilir.
- T (Sıcaklık): Kelvin cinsinden ölçülen sıcaklıktır. Sıcaklığın artması, gaz moleküllerinin kinetik enerjisini artırır, bu da basıncın artmasına neden olur.
R'nin Önemi ve Gazların Özellikleri
Gaz sabiti R, ideal gazların davranışlarını anlamada kritik bir rol oynar. Farklı gazlar için R'nin değeri sabit olsa da, her gazın moleküler yapısı ve özellikleri, gazın basıncı ve hacmi üzerindeki etkilerini belirler. Örneğin, farklı gazların sıcaklık artışına karşı duyarlılıkları ve basınç değişimi, moleküler ağırlıkları ve yapılarıyla doğrudan ilişkilidir. Bu nedenle, R'nin değeri gazların özelliklerini anlamak için bir temel oluştururken, gazların davranışını etkileyen diğer faktörler de dikkate alınmalıdır.
Sonuç olarak, ideal gaz yasası ve içindeki değişkenler, gazların fiziksel ve kimyasal özelliklerini anlamamıza yardımcı olur. Gaz basıncı, hacim, sıcaklık ve mol sayısı arasındaki ilişkiler, gazların çeşitli koşullar altında nasıl davrandığını anlamak için önemlidir.
Gaz basıncı formülünün belirlenmesinde nemin etkisi nedir? Nem değeri arttıkça gaz basıncında ne gibi değişiklikler olur? Bu konuda daha detaylı bilgi verebilir misiniz?
Abdülhamid., gaz basıncı formülünde nemin etkisi oldukça önemlidir. Nem, havadaki su buharı miktarını ifade eder ve su buharı da bir gaz olduğundan, toplam gaz basıncına katkıda bulunur. Nem arttıkça, havadaki su buharı miktarı da artar ve bu da toplam gaz basıncını yükseltir. Bu durumu ideal gaz kanunu (PV=nRT) ile de açıklayabiliriz. Su buharı, diğer gazların yerini alarak, kısmi basınçlarını değiştirir. Yani, nem oranı arttıkça, gaz karışımındaki su buharının kısmi basıncı artar ve bu da toplam basınca etki eder.
Özetle, nem değeri arttıkça gaz basıncı da artar çünkü su buharı da bir gaz olarak toplam basınca katkıda bulunur. Bu nedenle, gaz basıncı hesaplamalarında nem oranı dikkate alınmalıdır.