
Bikarbonat Formülü Nedir?
Bikarbonat, HCO₃⁻ iyonu olarak bilinen kimyasal bir bileşiktir. Genellikle sodyum bikarbonat (NaHCO₃) formunda bulunur ve gıda, temizlik ve tıbbi alanlarda geniş bir kullanım yelpazesine sahiptir. Sağlık açısından, asidokz baz dengesinde önemli bir rol oynar.
Bikarbonat, kimyasal olarak HCO₃⁻ iyonu şeklinde tanımlanan bir anyondur. İnsan sağlığı, çevre ve endüstriyel uygulamalar açısından önemli bir bileşiktir. Bikarbonat, genellikle sodyum bikarbonat (NaHCO₃) formunda bulunur. Bu form, yaygın olarak "kabartma tozu" olarak bilinir ve mutfaklarda, ilaçlarda ve temizlik ürünlerinde sıkça kullanılır. Bikarbonatın Kimyasal Özellikleri Bikarbonat, zayıf asidik özelliklere sahip bir tuzdur. Su ile reaksiyona girdiğinde, karbondioksit (CO₂) gazı açığa çıkarır. Bu özellik, bikarbonatın kabartma tozu olarak kullanımında önemli bir rol oynar. Bikarbonatın kimyasal özellikleri şunlardır:
Bikarbonatın Kullanım Alanları Bikarbonat, geniş bir kullanım yelpazesi ile birçok alanda yer almaktadır:
Bikarbonatın Sağlık Üzerindeki Etkileri Bikarbonat, insan sağlığı açısından da önemli bir rol oynamaktadır. Özellikle asidokz baz dengesinin korunmasında etkili olduğu bilinmektedir. Bikarbonatın sağlık üzerindeki etkileri şunlardır:
Bikarbonatın Yan Etkileri ve Dikkat Edilmesi Gerekenler Bikarbonatın aşırı kullanımı bazı yan etkilere yol açabilir. Bu nedenle dikkat edilmesi gereken noktalar şunlardır:
Sonuç Bikarbonat, hem günlük yaşamda hem de endüstriyel uygulamalarda önemli bir bileşiktir. Sağlık, gıda ve temizlik alanlarındaki kullanımları sayesinde, çok yönlü bir katkı sağlamaktadır. Ancak, kullanımı sırasında dikkatli olunmalı ve aşırıya kaçılmamalıdır. Bikarbonat, doğru kullanıldığında, sağlıklı bir yaşam tarzının destekleyicisi olabilir. Ekstra Bilgiler Bikarbonatın tarihçesi de oldukça ilginçtir. İlk olarak 1791 yılında Nicolas Leblanc tarafından keşfedilmiştir. Ayrıca, doğal olarak yer altı su kaynaklarında da bulunur. Bikarbonatın çevre dostu özellikleri, onu sürdürülebilir uygulamalarda popüler kılmaktadır. Bikarbonat, hem kimyasal yapısı hem de çeşitli kullanım alanları ile önemli bir bileşiktir. Eğitim, sağlık ve çevre alanları üzerinde sağladığı faydalarla dikkat çekmektedir. |
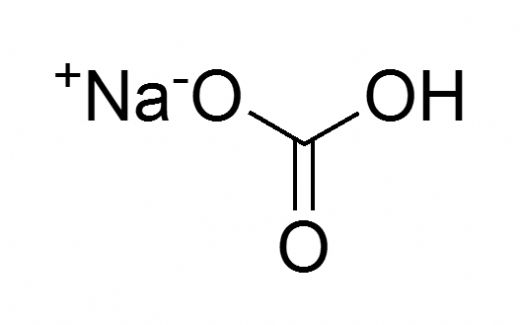















































Bikarbonat formülü hakkında daha fazla bilgi edinmek istiyorum. Özellikle bu bileşiğin kimyasal özellikleri ve evdeki kullanım alanları nelerdir? Bikarbonat formülü ile ilgili daha fazla detay verebilir misiniz?
Bikarbonat Formülü
Bikarbonat, kimyasal olarak sodyum bikarbonat (NaHCO₃) olarak bilinir. Genellikle kabartma tozu olarak kullanılır ve beyaz, kristal yapıda bir tozdur.
Kimyasal Özellikleri
Bikarbonat, hafif alkali bir bileşiktir ve su ile çözünebilir. Asitlerle tepkimeye girdiğinde karbondioksit gazı (CO₂) açığa çıkarır. Bu özellik, özellikle pişirme sırasında kabartma etkisi sağlamak için kullanılır. Ayrıca, ısıtıldığında su buharı ve karbondioksit gazı salgılar, bu da onun termal stabilitesinin düşük olduğunu gösterir.
Evdeki Kullanım Alanları
Bikarbonatın evde birçok kullanımı bulunmaktadır:
1. Pişirme: Kabartma tozu olarak, hamur işlerinin kabarmasını sağlar.
2. Temizlik: Doğal bir temizlik maddesi olarak, yüzeylerdeki lekeleri çıkarmak için etkili bir şekilde kullanılabilir.
3. Koku Giderici: Bikarbonat, kötü kokuları nötralize etme özelliğine sahiptir. Bu nedenle, buzdolabında veya ayakkabılarda kullanılır.
4. Diş Beyazlatma: Diş macunu ile karıştırılarak dişlerin beyazlatılmasına yardımcı olabilir.
5. Asidite Dengeleme: Mide asidini dengelemek için bazı kişiler tarafından kullanılır. Ancak, bu konuda bir doktora danışılması önerilir.
Bikarbonat, çok yönlü bir bileşiktir ve evde pek çok alanda pratik bir şekilde kullanılabilir.
Bikarbonatın erime noktası olan 50°C ve kaynama noktası olan 850°C arasındaki fark neden bu kadar büyük? Bu kadar yüksek bir kaynama noktasına sahip olması onun yapısal özellikleriyle mi ilgili?
Merhaba Sartık,
Bikarbonatın erime ve kaynama noktaları arasındaki büyük fark, evet, onun yapısal özellikleriyle ilgilidir. Bikarbonat (özellikle sodyum bikarbonat, NaHCO3) iyonik bir bileşiktir ve güçlü iyonik bağlara sahiptir. İyonik bağlar, oldukça yüksek miktarda enerji gerektiren güçlü çekim kuvvetleridir. Bu nedenle, bikarbonatın katı halden sıvı hale geçmesi için gereken enerji (erime noktası) nispeten düşüktür, ancak sıvı halden gaz haline geçmesi için gereken enerji (kaynama noktası) çok daha yüksektir. Bu da, bikarbonatın yüksek bir kaynama noktasına sahip olmasına neden olur. Umuyorum ki bu açıklama merakını gidermiştir.