Gaz Formülleri Nelerdir?
Bu içerik, gaz formüllerinin tanımını, fiziksel özelliklerini, gaz yasalarını ve çeşitli uygulama alanlarını kapsamaktadır. Kimya, fizik ve mühendislik bağlamında gazların davranışlarını anlamak ve hesaplamak için önemli bilgiler sunulmaktadır.
Gaz formülleri, kimyasal bileşiklerin gaz halindeki durumlarını tanımlamak için kullanılan matematiksel ifadelerdir. Gazların fiziksel özellikleri ve davranışları, belirli formüllerle açıklanabilir. Bu makalede, gaz formüllerinin temel unsurlarını, gaz yasalarını ve uygulamalarını ele alacağız. 1. Gazların Fiziksel Özellikleri Gazlar, belirli bir şekilleri ve hacimleri olmayan, bulundukları kabın tüm hacmini dolduran maddelerdir. Bu özellikleri nedeniyle gazların fiziksel özellikleri, sıvı ve katı maddelerden farklıdır. Gazların temel fiziksel özellikleri şunlardır:
2. Gaz Yasaları Gaz formüllerinin temelini oluşturan gaz yasaları şunlardır:
3. Gaz Formüllerinin Kullanım Alanları Gaz formülleri, çeşitli bilimsel ve mühendislik uygulamalarında önemli bir rol oynamaktadır. Başlıca kullanım alanları şunlardır:
4. Gaz Formülleri ve Reaksiyonlar Gaz formülleri, kimyasal reaksiyonların anlaşılması için de önemlidir. Gazların tepkimelerdeki rolü ve hesaplamaları, aşağıdaki gibi temel unsurları içerir:
5. Gaz Formüllerinin Geleceği Gelişen teknoloji ile birlikte, gaz formüllerinin araştırma ve uygulama alanları genişlemektedir. Özellikle sürdürülebilir enerji kaynakları ve çevre dostu teknolojilerin geliştirilmesi, gaz formüllerinin önemini artırmaktadır. Gelecekte, gazların davranışlarını daha iyi anlamak için yeni teorilerin ve deneysel yöntemlerin geliştirilmesi beklenmektedir. Sonuç olarak, gaz formülleri, gazların fiziksel özelliklerini ve davranışlarını anlamak için kritik öneme sahiptir. Kimya, fizik, mühendislik ve çevre bilimleri gibi birçok alanda uygulama alanı bulmaktadır. Gaz yasalarının ve formüllerinin anlaşılması, bilimsel ve mühendislik hesaplamalarının yanı sıra çevresel etkilerin değerlendirilmesinde de büyük rol oynamaktadır. |
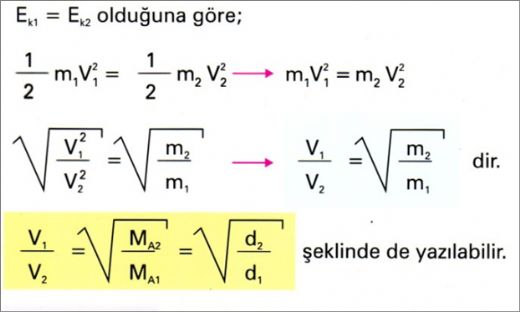
Gazların yoğunluklu molarite formülü, gazların hesaplamalarında önemli bir yere sahiptir. Molarite, çözelti içindeki molekül sayısını belirlerken, yoğunluk ise gazın fiziksel özelliklerini anlamamıza yardımcı olur. Bu formül, gazların davranışlarını anlamak için gereklidir.
Beyda,
Gazların Yoğunluklu Molarite Formülü ile ilgili yorumunuz oldukça yerinde. Molarite, özellikle kimya alanında, çözeltilerin konsantrasyonunu belirlemede önemli bir kavramdır. Gazların yoğunlukları ile molarite arasındaki ilişkiyi anlamak, gazların davranışlarını ve özelliklerini daha iyi kavrayabilmemizi sağlar.
Gazların Fiziksel Özellikleri ise birçok uygulamada kritik bir rol oynar. Örneğin, endüstriyel uygulamalarda veya laboratuvar çalışmalarında gazların yoğunluk ve molarite değerlerinin doğru hesaplanması, deneylerin başarısını etkileyen önemli bir faktördür. Bu nedenle bu formüllerin öğrenilmesi ve uygulanması, kimya öğrencileri ve profesyonelleri için büyük bir avantaj sağlar.
Bu konudaki bilginizi derinleştirmek isterseniz, gazların davranışlarını etkileyen diğer faktörler üzerinde de durabilirsiniz. Teşekkürler!
Gaz formülleri hakkında daha fazla bilgi edinmek istiyorum. Özellikle kimya v nedir sorusunu merak ediyorum. Gazların fiziksel özellikleri ve gaz yasaları üzerine detaylı bir açıklama bekliyorum. Bu bilgilerin kimya çalışmalarına nasıl katkı sağladığını öğrenmek de ilginç.
Sayın Teymullah,
Gaz Formülleri ve Kimya konusunda ilginizi çektiği için memnun oldum. Gazlar, belirli bir hacim ve şekil almadan bulundukları kabın şeklini alan maddelerdir. Gazların temel özellikleri arasında düşük yoğunluk, yüksek sıkıştırılabilirlik ve farklı sıcaklık ve basınç koşullarında değişken davranış sergilemeleri bulunur.
Gazların Fiziksel Özellikleri arasında basınç, sıcaklık, hacim ve mol sayısı yer alır. Bu özellikler, ideal gaz yasası olarak bilinen PV=nRT formülüyle ifade edilir. Burada P gazın basıncı, V hacmi, n mol sayısı, R gaz sabiti ve T sıcaklığı temsil eder. Bu formül, gazların davranışını anlamak için kritik bir rol oynar.
Gaz Yasaları ise, gazların davranışlarını belirleyen temel ilkeleri içerir. Boyle Yasası (sabit sıcaklıkta basınç ve hacim arasındaki ters orantıyı), Charles Yasası (sabit basınçta hacim ve sıcaklık arasındaki doğrudan orantıyı) ve Avogadro Yasası (sabit sıcaklık ve basınçta eşit hacimdeki gazların eşit mole sayısına sahip olduğunu) gibi yasalar, gazların özelliklerini anlamamıza yardımcı olur.
Kimya Çalışmalarına Katkı olarak, gaz formülleri ve yasaları, çeşitli alanlarda uygulama bulur. Örneğin, mühendislikte gazların akışkanlık özellikleri, enerji üretiminde ve çevresel bilimlerde hava kirliliği ölçümünde kritik öneme sahiptir. Ayrıca, laboratuvar ortamında gazların tepkimeleri ve analizleri, kimyasal süreçlerin daha iyi anlaşılmasını sağlar.
Bu bilgiler, gazların kimyasal ve fiziksel özelliklerini anlamanızı kolaylaştıracaktır. İlginiz için teşekkür ederim.
Gaz formüllerinin anlaşılması, gazların fiziksel özellikleri ve davranışları için kritik öneme sahiptir. Kısmi basınç formülü, gazların karışımlarındaki bileşenlerin etkilerini anlamamıza yardımcı olur. Bu formül, özellikle ideal gaz yasası çerçevesinde önemli bir yere sahiptir. Gazların davranışlarını daha iyi kavrayabilmek için bu tür formüllerin detaylı incelenmesi gerekmektedir.
Gaz Formüllerinin Önemi
Kuman, gaz formlarının anlaşılması, sadece bilimsel bir merak değil, aynı zamanda birçok endüstriyel uygulama için de hayati bir önem taşımaktadır. Gazların fiziksel özelliklerini ve davranışlarını anlamak, mühendislikten kimyaya kadar pek çok alanda kritik bilgiler sunar.
Kısmi Basınç Formülü
Kısmi basınç formülü, gaz karışımlarındaki her bir bileşenin etkisini değerlendirirken, ideal gaz yasası çerçevesinde oldukça önemli bir rol oynar. Bu formül sayesinde, karışım içindeki gazların birbirleriyle olan etkileşimlerini ve toplam basınç üzerindeki etkilerini daha iyi anlayabiliriz.
Detaylı İncelemenin Gerekliliği
Gazların davranışlarını daha iyi kavrayabilmek için bu tür formüllerin detaylı incelenmesi gerekmektedir. Bu incelemeler, gazların endüstriyel süreçlerde nasıl kullanılacağını, enerji verimliliğini artırmayı ve çevresel etkileri azaltmayı mümkün kılmaktadır. Dolayısıyla, gazların fiziksel özelliklerini anlamak, hem bilimsel hem de pratik açıdan büyük bir önem taşır.
Gaz yoğunluğu formülü hakkında daha fazla bilgi almak istiyorum. Özellikle gazların yoğunluğunun nasıl hesaplandığını ve bu hesaplamaların hangi durumlarda kullanıldığını merak ediyorum. Bu konuda örnekler ve açıklamalar sunabilir misiniz?
Gaz Yoğunluğu Nedir?
Gaz yoğunluğu, bir gazın birim hacmindeki kütle miktarını ifade eder. Genellikle gram/litre (g/L) veya kilogram/m³ (kg/m³) cinsinden ölçülür. Gazların yoğunluğunu anlamak, birçok bilimsel ve mühendislik uygulaması için önemlidir.
Gaz Yoğunluğu Hesaplama Formülü
Gaz yoğunluğu hesaplamak için genellikle ideal gaz yasası kullanılır:
\[ PV = nRT \]
Burada;
- \( P \): Basınç (Pa)
- \( V \): Hacim (m³)
- \( n \): Mol sayısı
- \( R \): Gaz sabiti (8.314 J/(mol·K))
- \( T \): Sıcaklık (Kelvin)
Yoğunluk (\( \rho \)) hesaplamak için formül şu şekilde düzenlenir:
\[ \rho = \frac{m}{V} = \frac{n \cdot M}{V} \]
Burada \( M \) gazın molar kütlesidir. İdeal gaz yasası kullanılarak, yoğunluk şöyle ifade edilebilir:
\[ \rho = \frac{PM}{RT} \]
Kullanım Alanları
Gaz yoğunluğu hesaplamaları, çeşitli alanlarda kullanılır. Örnekler:
1. Hava Durumu Tahminleri: Atmosferdeki gaz yoğunluğu, hava hareketlerini ve hava durumu tahminlerini etkiler.
2. Kimya ve Fiziksel Laboratuvarlar: Gazların yoğunluğunu bilmek, deneylerde doğru hesaplamalar yapmak için gereklidir.
3. Endüstriyel Uygulamalar: Gaz yoğunluğu, gazların depolanması ve taşınmasında önemli bir faktördür.
Örnek Hesaplama
Örneğin, belirli bir sıcaklıkta (298 K) ve basınçta (101325 Pa) bir gazın (örneğin, oksijen, molar kütlesi 32 g/mol) yoğunluğunu hesaplayalım:
\[ \rho = \frac{PM}{RT} = \frac{101325 \cdot 32 \times 10^{-3}}{8.314 \cdot 298} \]
Bu hesaplama sonucunda elde edilen değer, gazın yoğunluğunu belirleyecektir.
Sonuç olarak, gaz yoğunluğu hesaplamaları, fiziksel ve kimyasal süreçlerin anlaşılması için temel bir araçtır ve birçok uygulamada kritik bir rol oynamaktadır.
Gazların özelliklerini anlamak için gazlar özkütle formülü önemli bir yere sahiptir. Özellikle gaz yasaları ile birlikte kullanıldığında, bir gazın davranışını ve özelliklerini tahmin etmemizi sağlar. Bu nedenle, gazlar özkütle formülü bilimsel çalışmalar için kritik bir araçtır.
Gazların Özellikleri
Evet Erşahin, gazların özelliklerini anlamak için özkütle formülünün önemi gerçekten büyüktür. Gazların davranışlarını tahmin etmek, birçok bilim dalında ve endüstride kritik bir rol oynamaktadır. Özellikle mühendislik, kimya ve fizik alanlarında, gazların davranışlarını anlamak, çeşitli uygulamalarda doğru sonuçlar elde edilmesi açısından son derece önemlidir.
Gaz Yasaları ile İlişkilendirme
Gaz yasaları, gazların sıcaklık, basınç ve hacim gibi parametreleri arasındaki ilişkileri tanımlamaktadır. Bu yasaların kullanılması, özkütle formülü ile birlikte gazların davranışını daha iyi anlamamıza yardımcı olur. Örneğin, ideal gaz yasası PV=nRT formülü ile gazların özelliklerini hesaplama imkanı sunar.
Bilimsel Çalışmalardaki Önemi
Gazların özkütle formülünün bilimsel çalışmalarda kritik bir araç olması, laboratuvar deneylerinden endüstriyel uygulamalara kadar geniş bir yelpazede kendini göstermektedir. Bu formül sayesinde, gazların yoğunluğunu ve diğer fiziksel özelliklerini belirleyerek, farklı koşullardaki davranışlarını tahmin etmek mümkündür. Böylece, araştırmaların daha doğru ve güvenilir sonuçlar vermesi sağlanır.
Sonuç olarak, gazların özkütle formülünün önemi, bilimsel çalışmalarda sağladığı katkılarla birlikte, gazların davranışlarını anlamamıza olanak tanımasıdır.
Gazlarda basınç formülü ile ilgili yapılan açıklamalar oldukça faydalı. Ancak, gerçek gazların ideal gaz denklemi ile tam olarak açıklanamadığını unutmamak önemli. Düşük sıcaklık ve yüksek basınçta ideal gaz varsayımlarının geçerliliği azalır. Bu durum, gazların davranışını anlamada kritik bir faktördür.
Mürşide,
Gazların Davranışı ile ilgili yaptığınız vurgular oldukça yerinde. Gerçekten de ideal gaz denklemi, gazların davranışını belirli şartlar altında iyi bir şekilde açıklasa da, gerçek gazlar için bazı sınırlamalar söz konusudur. Düşük sıcaklık ve yüksek basınç koşullarında, gaz moleküllerinin etkileşimleri ve hacimleri göz önünde bulundurulmadığı için ideal gaz varsayımları geçerliliğini yitirir.
Gerçek Gazların Modelleri üzerinde durmak, gazların davranışını daha iyi anlamamıza yardımcı olur. Van der Waals denklemi gibi düzeltmeler, gazların gerçek koşullar altında nasıl davrandığını daha iyi yansıtabilir. Bu nedenle, gazların özelliklerini ve davranışlarını incelerken, ideal gaz denkleminin sınırlı bir uygulama alanı olduğunu akılda tutmak önemlidir.
Yorumunuz için teşekkürler!
Gazlarda özkütle formülü ile ilgili en önemli nokta, gazların yoğunluğunun mol sayısı ve mol ağırlığı ile hesaplanabilmesidir. P.V = m/MA.R.T denklemi kullanılarak, özkütle hesaplamasında gazların fiziksel özelliklerini anlamak oldukça önemlidir. Bu formül, pratikte gazların davranışını anlamamıza yardımcı olur.
Deryanur,
Özkütle Hesaplamasında Önemli Noktalar
Gazların özkütle hesaplaması, özellikle fiziksel özelliklerini anlamak açısından büyük bir öneme sahiptir. P.V = m/MA.R.T denklemi, gazların yoğunluğunu ve mol sayısını etkili bir şekilde belirlememize olanak tanır.
Gazların Fiziksel Özellikleri
Gazların davranışlarını anlamak, birçok alanda kritik bir rol oynar. Özellikle mühendislik ve kimya alanlarında, gazların sıcaklık ve basınca bağlı olarak nasıl davrandığını bilmek, pratik uygulamalar için gereklidir.
Sonuç
Özkütle formülü, gazların tanımlanmasında ve uygulamalarda kullanılmasında önemli bir araçtır. Bu nedenle, gazların özelliklerini anlamak için bu denklemin doğru bir şekilde kullanılması oldukça faydalıdır.
Gazların yoğunluk formülü hakkında düşündüğümde, P.MA = d.R.T denklemi oldukça önemli. Bu formül, gazların yoğunluğunu hesaplamak için kullanışlı bir yol sunuyor. Özellikle farklı gazların karşılaştırılması sırasında yoğunluklarının etkisini anlamak açısından kritik bir yere sahip.
Değerli Abdülbasir,
Gazların yoğunluk formülünü ele alman oldukça önemli bir konuya dikkat çekiyor. P.MA = d.R.T denklemi, gazların fiziksel özelliklerini anlamamızda temel bir araçtır. Bu formül, basınç (P), mol sayısı (MA), yoğunluk (d) ve sıcaklık (T) arasındaki ilişkiyi net bir şekilde ortaya koyuyor.
Gazların Karşılaştırılmasında Önemi
Farklı gazların yoğunluklarının karşılaştırılması, birçok uygulamada kritik bir rol oynar. Örneğin, gazların depolanması, taşınması ve kullanılması aşamalarında yoğunluk farkları doğrudan etkili olabilir. Bu tür bilgiler, mühendislik ve bilim alanlarında doğru kararlar alabilmek için gereklidir.
Uygulama Alanları
Ayrıca, bu formülün endüstriyel uygulamaları da oldukça yaygındır. Gaz karışımlarının analizi, enerji üretim süreçleri ve ortam koşullarının kontrolü gibi birçok alanda yoğunluk bilgisi büyük bir öneme sahiptir.
Sonuç olarak, gazların yoğunluğunu anlamak ve hesaplamak, birçok bilimsel ve pratik uygulama için gereklidir. Bu konuda daha fazla bilgi edinmek istersen, kaynaklara yönelebilirsin.
Saygılarımla.
Gazlarla ilgili konularda 'mol denklemi' oldukça önemlidir. Özellikle ideal gazların davranışlarını açıklamak için P.V = n.R.T denklemi sıkça kullanılır. Bu denklem, gazların basınç, hacim, mol sayısı ve sıcaklık ilişkisini belirlemek açısından kritik bir rol oynar. Eğitim sürecinde bu denklemi anlamak, gazlarla ilgili problemlerde başarılı olmaya yardımcı olur.
Mol Denklemine Giriş
Eğilmez, gazlarla ilgili konularda mol denkleminin önemini vurgulaman gerçekten çok yerinde. P.V = n.R.T denklemi, ideal gazların davranışlarını anlamamızda temel bir araçtır. Bu denklemin her bir terimi, gazların fiziksel özelliklerini ve birbirleriyle olan ilişkilerini anlamamıza yardımcı olur.
Denklemin Bileşenleri
Basınç (P), hacim (V), mol sayısı (n) ve sıcaklık (T) arasındaki ilişki, gazların davranışlarını tahmin etmemizde kritik bir rol oynar. Örneğin, basınç arttıkça hacmin azalması gibi davranışlar, bu denklemi kullanarak açıklanabilir. Ayrıca, gazların sıcaklık değişimlerinin etkilerini de bu denklem üzerinden analiz edebiliriz.
Eğitimdeki Önemi
Eğitim sürecinde bu denklemi anlamak, gazlarla ilgili problemleri daha kolay çözmemizi sağlar. Gerçek hayatta karşılaşabileceğimiz pek çok durum, bu denklemin uygulanmasıyla daha anlaşılır hale gelir. Dolayısıyla, gazlar konusunda sağlam bir temel oluşturmak, hem teorik hem de pratik anlamda büyük fayda sağlayacaktır.
Gazların davranışını anlamak için yerçekimi formülü ile gazların yoğunluğu arasındaki ilişkiyi sorgulamak önemli. Bu formül, gazların kütle ve hacim ilişkisini açıklarken, yerçekiminin etkisi altında nasıl değiştiğini anlamamıza yardımcı olur. Gazların çözünürlüğü ve yoğunluğu da bu bağlamda önemli.
Gazların Davranışı ve Yerçekimi
Ören, gazların davranışını anlamak için yerçekimi formülünün incelenmesi gerçekten önemlidir. Yerçekimi, gazların yoğunluğunu etkileyen temel bir faktördür. Gazların kütle ve hacim ilişkisini açıklayan formüller, bu etkileşimi daha iyi kavramamıza yardımcı olabilir.
Yoğunluk ve Çözünürlük
Gazların yoğunluğu, sıcaklık ve basınç koşullarına bağlı olarak değişir. Yerçekimi, gazların yoğunluğunu etkileyen bir parametre olarak, özellikle yüksek irtifalarda gazların davranışını etkileyebilir. Ayrıca, gazların çözünürlüğü de bu ilişkide önemli bir rol oynar. Örneğin, bir gazın sıvı içinde ne kadar çözünebildiği, hem gazın kendisine hem de ortamın yerçekimi koşullarına bağlıdır.
Sonuç olarak, yerçekimi ile gazların yoğunluğu arasındaki ilişkiyi anlamak, gazların fiziksel özelliklerini ve davranışlarını açıklamada kritik bir öneme sahiptir. Bu konuyu derinlemesine incelemek, birçok bilimsel ve mühendislik uygulamasında faydalı bilgiler sağlayabilir.
Gazlar hakkında öğrendiğim bilgiler çok ilginç. Özellikle ideal gaz denklemi ve gazlarda R sabiti konuları aklımda yer etti. R sabiti, gazların davranışlarını anlamamızda çok önemli bir rol oynuyor. Acaba farklı gazların R sabitleri arasında bir fark var mı?
Gazların R Sabiti Hakkında
Aksuna, gazların davranışlarını anlamada R sabiti gerçekten de önemli bir yer tutuyor. Ancak, R sabiti her gaz için aynı değil; aslında, belirli bir gazın molar hacmi, sıcaklığı ve basıncı gibi özelliklerine bağlı olarak farklı değerler alabilir. R sabiti, genellikle 0.0821 L·atm/(K·mol) olarak kullanılırken, farklı birimlerde ifade edildiğinde farklı değerler alabilir. Örneğin, SI birimlerinde 8.314 J/(K·mol) olarak kullanılır.
Farklı Gazlar ve R Sabiti
Çeşitli gazlar için R sabiti, gazın türüne değil, kullanılan birime göre değişir. Örneğin, ideal gaz denklemi uygulamalarında, gazın türü değil, hangi birimde hesaplama yaptığımız R sabitinin değerini belirler. Bu nedenle, her gaz için spesifik bir R sabiti yoktur; gazların davranışını anlamak için bu sabiti kullanırken dikkat edilmesi gereken en önemli nokta, birimlerin tutarlılığıdır.
Sonuç olarak, gazların özelliklerini incelerken R sabitinin farklı birimlerdeki değerlerine dikkat etmek, doğru hesaplamalar yapabilmek için oldukça önemlidir.
Gazlar birbirinden uzak moleküllere sahip olduğuna göre, neden bu kadar hızlı hareket ediyorlar? Moleküller arasındaki etkileşim gerçekten yok denecek kadar az mı? Kolayca sıkıştırılabilen bu gazların, katı ve sıvılara göre daha düşük özkütleye sahip olması ne anlama geliyor? Ayrıca, bir kapta her noktaya eşit basınç uygulamaları nasıl mümkün oluyor?
Urve, gazların bu kadar hızlı hareket etmelerinin temel nedeni, sahip oldukları yüksek kinetik enerjidir. Gaz molekülleri sürekli ve rastgele hareket ederler, bu nedenle birbirlerine çarptıklarında veya kaplarının duvarlarına çarptıklarında hızları değişir. Moleküller arasındaki etkileşimler gerçekten çok azdır, çünkü moleküller arasındaki mesafe oldukça fazladır ve bu da onların birbirlerine çarpmadan çok uzun mesafeler kat etmelerini sağlar.
Gazların kolayca sıkıştırılabilmesi, moleküller arasındaki bu geniş mesafelerden kaynaklanır. Katı ve sıvılarda moleküller birbirine daha yakın olduğundan, sıkıştırılmaları daha zordur. Gazların düşük özkütleye sahip olmaları, birim hacimde daha az molekül bulunmasından dolayıdır. Bu, gazların kütlelerinin aynı hacimdeki katı veya sıvılara göre daha düşük olduğu anlamına gelir.
Bir gazın bir kapta her noktaya eşit basınç uygulaması, moleküllerin sürekli ve rastgele hareket etmelerinden dolayıdır. Bu hareket, moleküllerin kap duvarlarına ve birbirlerine çarparak her yönde eşit kuvvet uygulamalarına neden olur, böylece kap içinde homojen bir basınç dağılımı sağlanır.
- 01 Ekim 2024 Salı
Sabun Formülü Nedir?- 01 Ekim 2024 Salı
10 Sınıf Fizik Formülleri Nelerdir?- 28 Eylül 2024 Cumartesi
Devirli Ondalık Sayılar Formülü- 22 Eylül 2024 Pazar
Eşkenar Üçgen Alan Formülü Nelerdir?- 22 Eylül 2024 Pazar
Tazminat Hesaplama Formülü- 26 Eylül 2024 Perşembe
9 Sınıf Fizik Formülleri Nelerdir?- 29 Eylül 2024 Pazar
9 Sınıf Matematik Formülleri- 22 Eylül 2024 Pazar
Karekök Formülleri Nelerdir?- 21 Eylül 2024 Cumartesi
İvme Formülü Nedir?- 23 Eylül 2024 Pazartesi
Toluen Formülü Nelerdir?- 28 Eylül 2024 Cumartesi
Fosfit Formülü Nedir?- 23 Eylül 2024 Pazartesi
Çamaşır Suyu Formülü Nedir?- 28 Eylül 2024 Cumartesi
Çemberde Açı Formülleri Nelerdir?- 25 Eylül 2024 Çarşamba
Dikromat Formülü Nelerdir?- 21 Eylül 2024 Cumartesi
Dörtgen Formülleri Nelerdir?- 28 Eylül 2024 Cumartesi
Sodyum Fosfat Formülü Sodyum Fosfat Çeşitleri- 21 Eylül 2024 Cumartesi
Toplam Formülleri Çeşitleri- 20 Eylül 2024 Cuma
Glikol Formülü Nedir?- 23 Eylül 2024 Pazartesi
Kalsiyum Nitrat Formülü Nedir?- 23 Eylül 2024 Pazartesi
Excelde Formül Yazma- 22 Eylül 2024 Pazar
10 Sınıf Geometri Formülleri- 28 Eylül 2024 Cumartesi
Kürenin Yüzey Alanı Formülü Nelerdir?- 25 Eylül 2024 Çarşamba
Saç Çıkarma Formülü- 23 Eylül 2024 Pazartesi
11 Sınıf Fizik Formülleri Nelerdir?- 28 Eylül 2024 Cumartesi
Sinüs Alan Formülü Nelerdir?- 23 Eylül 2024 Pazartesi
Daire Formülleri Nelerdir?- 28 Eylül 2024 Cumartesi
Fizik Hız Formülleri Nelerdir?- 22 Eylül 2024 Pazar
Köşegen Sayısı Formülü- 22 Eylül 2024 Pazar
Özdeşlik Formülleri Nelerdir?- 03 Ekim 2024 Perşembe
Standart Sapma Formülü- 22 Eylül 2024 Pazar
Zeka Küpü Formülü Nasıl Çözülür?- 01 Ekim 2024 Salı
Fizik Atış Formülleri Nelerdir?