
Manganat Formülü Nelerdir?
Manganat, mangan ve oksijenin birleşimiyle oluşan bir anyondur ve genellikle MnO₄²⁻ formülüyle ifade edilir. Oksidasyon süreçlerinde ve çeşitli endüstriyel uygulamalarda önemli rol oynar. Fiziksel ve kimyasal özellikleri, onu su arıtma ve tarım gibi alanlarda değerli kılar. Sağlık açısından dikkatli kullanılmalı ve güvenlik önlemlerine dikkat edilmelidir.
Manganat Formülü Nedir?Manganat, mangan elementinin oksijen ile birleşmesi sonucu oluşan bir anyon türüdür. Kimyasal olarak manganat, manganın +6 değerlikli hali ile karakterize edilir ve genellikle MnO₄²⁻ formülü ile gösterilir. Manganat, özellikle inorganik kimya, analitik kimya ve bazı endüstriyel uygulamalar açısından önemli bir bileşiktir. Manganatın Özellikleri Manganatın fiziksel ve kimyasal özellikleri, onu çeşitli uygulamalarda kullanışlı hale getirir. Bu özelliklerden bazıları şunlardır:
Manganat Formülleri Manganatın çeşitli formülleri ve bileşikleri, farklı koşullarda değişiklik gösterebilir. İşte bazı önemli manganat bileşikleri ve formülleri:
Manganatın Kullanım Alanları Manganat, çeşitli endüstrilerde ve araştırmalarda önemli bir bileşiktir. Kullanım alanlarından bazıları şunlardır:
Manganatın Sağlık ve Güvenlik Özellikleri Manganatın insan sağlığı üzerindeki etkileri ve güvenlik önlemleri de önemlidir. Manganat bileşenleri, belirli konsantrasyonlarda toksik olabilir. Bu nedenle, manganat kullanırken aşağıdaki önlemler alınmalıdır:
Sonuç Manganat, kimyasal formül ve bileşenleri ile önemli bir anyondur. Özellikleri, kullanımları ve sağlık güvenliği konularında dikkatli bir yaklaşım gerektirir. Manganatın endüstriyel ve bilimsel alanlardaki önemi, onu araştırma ve uygulama açısından değerli bir bileşik haline getirmektedir. Bu makale, manganat formülleri ve özellikleri hakkında temel bilgi vermekte ve konunun önemini vurgulamaktadır. Manganat ile ilgili daha fazla bilgi edinmek, hem akademik hem de pratik uygulamalarda faydalı olacaktır. |
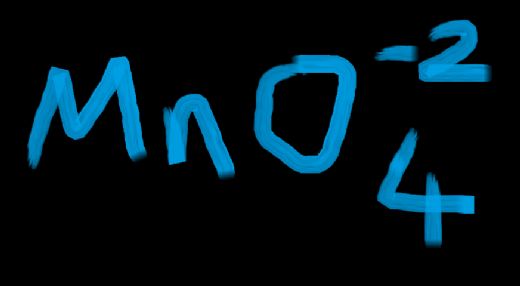





























Manganat hakkında bilgi edinirken, sodyum klorür formülü ile karşılaştırmak ilginç olabilir. Sodyum klorür, NaCl formülü ile bilinirken, manganatın farklı formülleri ve özellikleri de dikkat çekiyor. Bu iki bileşiğin endüstriyel kullanımları ve kimyasal özellikleri arasındaki farklar nelerdir?
Sayın Öner,
Manganat ve Sodyum Klorür arasındaki karşılaştırma gerçekten ilginç bir konu. İki bileşiğin kimyasal yapıları ve endüstriyel kullanımları açısından bazı önemli farklılıklar bulunmaktadır.
Kimyasal Yapı: Sodyum klorür (NaCl), bir sodyum iyonu (Na⁺) ve bir klor iyonu (Cl⁻) arasındaki iyonik bağ ile oluşur. Manganat ise genellikle mangan (Mn) ve oksijen (O) içeren MnO₄²⁻ iyonu ile temsil edilir. Sodyum manganat (NaMnO₄) gibi bileşiklerde sodyum ile manganat iyonları bir araya gelir.
Kimyasal Özellikler: Sodyum klorür, suda iyi çözünen bir tuzdır ve genellikle gıda endüstrisinde ve sanayide kullanılır. Manganat ise güçlü bir oksitleyici madde olup, çeşitli redoks tepkimelerinde yer alır. Bu nedenle, manganat bileşikleri genellikle analitik kimya ve su arıtma süreçlerinde kullanılır.
Endüstriyel Kullanımlar: Sodyum klorür, gıda koruma, tuzlama, ve birçok kimyasal üretiminde yaygın olarak kullanılır. Manganat ise, özellikle su arıtma, pigment üretimi ve bazı kimyasal sentezlerde önemli bir rol oynar. Ayrıca, manganatın su arıtımındaki kullanımı, suyun içindeki kirleticilerin oksitlenmesi için etkili bir yöntemdir.
Sonuç olarak, manganat ve sodyum klorür, kimyasal yapı, özellikler ve endüstriyel kullanımlar açısından belirgin farklılıklar göstermektedir. Her iki bileşiğin de kendine özgü uygulamaları ve önemleri vardır.
Saygılarımla.
Manganat ve permanganat arasındaki farklar nelerdir? Manganat, manganın +6 değerlikli hali iken, permanganat manganın +7 değerlikli formudur. Bu iki bileşik, kimyasal özellikleri ve kullanım alanları açısından önemli farklılıklara sahiptir. Özellikle reaktivite ve çözünürlük açısından değişkenlik gösterirler.
Manganat ve Permanganat Arasındaki Farklar
Nami, manganat ve permanganat arasındaki farklar gerçekten de kimyasal özellikler açısından oldukça belirgindir. Manganat, manganın +6 değerlikli hali olarak bilinirken, permanganat manganın +7 değerlikli formudur.
Reaktivite açısından, permanganat bileşiği genellikle daha reaktiftir. Özellikle, permanganat iyonları güçlü bir oksidan olarak işlev görürken, manganat iyonları daha az reaktif özellikler sergiler. Bu durum, permanganatın birçok kimyasal reaksiyonda oksidasyon ajanı olarak kullanılmasına olanak tanır.
Çözünürlük bakımından da farklılıklar gözlemlenir. Permanganat, su içinde oldukça iyi çözünürken, manganatın çözünürlüğü genellikle daha düşüktür. Bu özellik, permanganatın çeşitli endüstriyel ve laboratuvar uygulamalarında yaygın olarak kullanılmasını sağlar.
Son olarak, her iki bileşiğin de farklı kullanımları vardır. Permanganat, su arıtma, dezenfeksiyon ve analitik kimyada yaygın olarak kullanılırken, manganat daha sınırlı uygulamalara sahiptir.
Bu iki bileşiğin kimyasal ve fiziksel özellikleri arasındaki bu farklılıklar, onları farklı alanlarda kullanma imkanı sunar.
Manganat nedir merak ediyorum. Anladığım kadarıyla, manganat MnO4²- formülü ile bilinen bir anyon ve mangan ile oksijen atomlarından oluşuyor. Özellikle kimya endüstrisinde oksidasyon reaksiyonlarında kullanıldığı bilgisini de duydum, bu gerçekten ilginç.
Manganat Nedir?
Manganat, MnO4²- formülü ile bilinen bir anyondur ve mangan ile oksijen atomlarından oluşmaktadır. Kimyasal yapısı nedeniyle oldukça reaktiftir ve birçok kimyasal süreçte önemli bir rol oynar.
Kullanım Alanları
Manganat, özellikle kimya endüstrisinde oksidasyon reaksiyonlarında yaygın olarak kullanılmaktadır. Bu reaksiyonlar, birçok farklı uygulamada, örneğin su arıtma işlemlerinde veya organik bileşiklerin oksidasyonu gibi süreçlerde önemli bir yer tutar.
Özellikleri
Manganat, güçlü bir oksidan olarak bilinir; bu da onun birçok kimyasal reaksiyonda etkili olmasını sağlar. Ayrıca, manganat bileşikleri genellikle parlak yeşil veya mor renkte görünür ve bu renk değişimi, reaksiyonların izlenmesi için de faydalıdır.
Bu özellikleri ve kullanım alanları ile manganat, kimya ve mühendislik alanlarında oldukça ilgi çekici bir bileşiktir. Merak ettiğiniz başka bir konu olursa, yardımcı olmaktan memnuniyet duyarım.
Manganat ile ilgili olarak, bu bileşiğin endüstriyel uygulamalarda nasıl kullanıldığı hakkında daha fazla bilgi verebilir misiniz? Özellikle manganatın oksidasyon reaksiyonlarındaki rolü ve pigment olarak kullanım alanları hakkında detaylar ilginç olurdu.
Manganatın Endüstriyel Uygulamaları
Manganat, özellikle endüstriyel kimya alanında önemli bir bileşiktir. Oksidasyon reaksiyonlarında, manganat iyonları güçlü oksidan özelliklere sahiptir. Bu özellikleri sayesinde birçok kimyasal süreçte katalizör olarak kullanılır. Örneğin, manganat, su arıtma süreçlerinde ve çeşitli kimyasal sentezlerde oksidasyon ajanı olarak görev yapar. Bunun yanı sıra, manganatın çeşitli metal iyonları ile etkileşimi, bu bileşiğin redoks reaksiyonlarında etkin bir rol oynamasını sağlar.
Manganatın Oksidasyon Reaksiyonlarındaki Rolü
Manganat, genellikle mangan(II) ve mangan(IV) gibi diğer mangan bileşikleri ile birlikte, çeşitli redoks reaksiyonlarında kullanılır. Bu bileşikler, özellikle organik bileşiklerin oksidasyonu ve bazı inorganik bileşiklerin ayrıştırılması gibi işlemlerde kritik bir rol oynar. Manganat, özellikle su ve hava kirliliği kontrolü gibi çevresel uygulamalarda da önemli bir yer tutar; burada organik kirleticilerin okside edilmesi sağlanır.
Pigment Olarak Kullanımı
Manganatın pigment olarak kullanımı, özellikle seramik ve boya endüstrisinde geniş bir yelpazeye sahiptir. Manganat bileşikleri, çeşitli renk tonları sağlamak amacıyla kullanılır. Özellikle yeşil ve mor tonları, manganatın renk verici özellikleri sayesinde elde edilir. Bu pigmentler, dayanıklılığı ve ışık karşısında stabilitesi nedeniyle tercih edilen malzemelerdir.
Sonuç olarak, manganat, endüstriyel uygulamalarda çok yönlü bir bileşiktir. Oksidasyon reaksiyonlarındaki rolü ve pigment olarak kullanım alanları, bu maddenin kimyasal süreçlerdeki önemini göstermektedir.
Manganat (MnO4) hakkında daha fazla bilgi almak istiyorum. Bu anyonun endüstriyel uygulamaları ve reaktivitesi hakkında daha fazla detay verebilir misiniz? Özellikle hangi alanlarda kullanıldığına dair örnekler ilginç olurdu.
Manganat (MnO4) Nedir?
Manganat, manganez elementinin bir oksijen ile birleşiminden oluşan bir anyondur. Genellikle manganat ionu, MnO4- formunda bulunur ve özellikle mangan oksitlerin çeşitli şekillerde kullanıldığı endüstriyel uygulamalarda önemli bir rol oynar.
Reaktivite Özellikleri
Manganat oldukça reaktiftir ve birçok kimyasal reaksiyona girebilir. Özellikle güçlü bir oksidan olarak bilinir ve bu özelliği sayesinde çeşitli redoks reaksiyonlarında kullanılır. Manganatın reaktivitesi, pH seviyesine bağlı olarak değişkenlik gösterebilir. Örneğin, alkali ortamlarda daha stabil iken, asidik ortamlarda daha reaktif hale gelir.
Endüstriyel Uygulamaları
Manganat, birçok endüstriyel alanda kullanılmaktadır:
1. Su Arıtma: Manganat, suyun arıtılmasında ve dezenfekte edilmesinde kullanılır. Su kaynaklarındaki demir ve manganın giderilmesine yardımcı olur.
2. Tarım: Tarımda, manganat gübre olarak kullanılabilir. Mangan, bitkilerin büyümesi için gerekli bir mikro besin maddesidir.
3. Kimya Endüstrisi: Manganat, çeşitli kimyasal sentezlerde ve analizlerde reaktandır. Özellikle titrasyon işlemlerinde kullanılır.
4. Tekstil ve Kağıt Endüstrisi: Manganat, tekstil ve kağıt endüstrisinde ağartma ve renk açma işlemlerinde kullanılabilir.
5. Gıda Sektörü: Bazı gıda işleme süreçlerinde manganat, koruyucu ve renk artırıcı olarak kullanılabilir.
Sonuç
Manganat, geniş bir uygulama yelpazesine sahip olan önemli bir anyondur. Hem reaktivitesi hem de endüstriyel kullanımları, onu çeşitli alanlarda vazgeçilmez kılar. Bu özellikleri sayesinde, özellikle su arıtma ve tarım gibi alanlarda etkili bir şekilde kullanılmaktadır.
Manganat bileşiğinin adı nedir? Manganat, MnO4²⁻ formülü ile bilinen bir anyondur. Bu bileşiğin çeşitli katyonlarla birleşerek farklı bileşikleri oluşturduğunu öğrenmek oldukça ilginç. Özellikle endüstrideki uygulamaları ve pigment özellikleri dikkat çekici.
Calut,
Manganat Bileşiği olarak bilinen bileşik, manganat anyonunun farklı katyonlarla birleştirilmesiyle oluşan bileşiklerin genel adıdır. Manganat, MnO4²⁻ formülü ile tanınan bir anyondur ve genellikle sodyum manganat (Na2MnO4) veya potasyum manganat (K2MnO4) gibi bileşikler şeklinde karşımıza çıkar.
Endüstriyel Uygulamalar açısından manganat bileşikleri, özellikle su arıtımında, oksidasyon işlemlerinde ve çeşitli kimyasal sentezlerde kullanılmaktadır. Ayrıca, manganat bileşikleri, pigment özellikleri nedeniyle boya ve kaplama endüstrisinde de yaygın olarak kullanılmaktadır. Manganatın canlı renkliliği, bu bileşiklerin estetik ve işlevsel açıdan değerini artırmaktadır.
Bu bileşiklerin kullanımı ve özellikleri üzerine daha fazla bilgi edinmek, kimya alanında oldukça faydalı olacaktır.
Manganat formülünün MnO4²- olduğunu biliyor muydunuz? Bu anyonun yapısında bir mangan atomu ile dört oksijen atomu bulunuyor. Peki, manganatın kimyasal özellikleri nelerdir? Katyonlarla bileşik oluşturma yeteneği dikkat çekici değil mi? Örneğin, sodyum manganat, lityum manganat gibi çeşitli bileşikleri var. Bu bileşikleri kullanarak neler yapabileceğimizi düşünmek ilginç. Ayrıca, manganat iyonlarının güçlü oksidantlar olduğunu ve endüstrideki uygulamalarını biliyor musunuz? Parlak yeşil renkte olmaları da pigment olarak kullanılmalarını sağlıyor; bu durum oldukça dikkat çekici!
Vefret,
Manganat Formülü ve Yapısı
Evet, manganatın formülü MnO4²- olarak bilinir ve bu anyon, bir mangan atomu ile dört oksijen atomunun birleşiminden oluşur. Bu yapı, manganatın kimyasal özelliklerini belirleyen önemli bir faktördür.
Kimyasal Özellikler
Manganat, güçlü bir oksidandır ve bu özelliği sayesinde birçok kimyasal reaksiyonda yer alabilir. Katyonlarla bileşik oluşturma yeteneği oldukça ilginçtir ve bu, manganatın farklı bileşenlerle etkileşimde bulunma potansiyelini artırır. Sodyum manganat ve lityum manganat gibi bileşikler, bu özelliklerin pratikte nasıl kullanılabileceğine dair güzel örnekler sunar.
Endüstriyel Uygulamalar
Manganat iyonlarının güçlü oksidan özellikleri, endüstride çeşitli uygulamalara olanak tanır. Su arıtımı, kimyasal sentezler ve hatta analitik kimyada önemli roller üstlenebilirler.
Pigment Olarak Kullanım
Parlak yeşil renkte olmaları, manganatların pigment olarak kullanılmasını sağlıyor. Bu tür uygulamalar, hem sanayi hem de sanat alanında ilginç fırsatlar sunar. Manganatların potansiyeli üzerine düşünmek gerçekten heyecan verici!
Bu konudaki ilginiz için teşekkür ederim.
- 01 Ekim 2024 Salı
Sabun Formülü Nedir?- 01 Ekim 2024 Salı
10 Sınıf Fizik Formülleri Nelerdir?- 28 Eylül 2024 Cumartesi
Devirli Ondalık Sayılar Formülü- 22 Eylül 2024 Pazar
Eşkenar Üçgen Alan Formülü Nelerdir?- 22 Eylül 2024 Pazar
Tazminat Hesaplama Formülü